آب
یکی از مواد مایع و فراوانترین ماده مرکب بر روی
سطح کره زمین و بستر اولیه حیات به شکلی که امروزه میشناسیم، است.
بیش از ۷۱٫۱٪ وزن یک انسان از آب تشکیل شدهاست
و نیز بیش از ۶۸٪ سطح کره زمین را آب پوشاندهاست
(نزدیک به ۳۶۰ میلیون از ۵۱۰ میلیون کیلومتر مربع)
با وجود این حجم عظیم آب تنها ۳ درصد از
آبهای کره زمین شیرین و قابل شرب است
و باقی آن به علت محلول بودن
انواع نمکها خصوصاً نمک خوراکی غیرقابل استفاده است.
از همین سه درصد آب شیرین
و ۲درصد منجمد در دوقطب شمال و جنوب
بیش از ۹۴ درصد به صورت شور است
بیشترین چگالی آب خالص در
دمای ۳٫۹۸ درجه سلسیوس (۳۹٫۱۶ درجه فارنهایت) حاصل میشود
که برابر ۱ گرم بر سانتیمتر مکعب
یا ۱۰۰۰ کیلوگرم بر متر مکعب است.
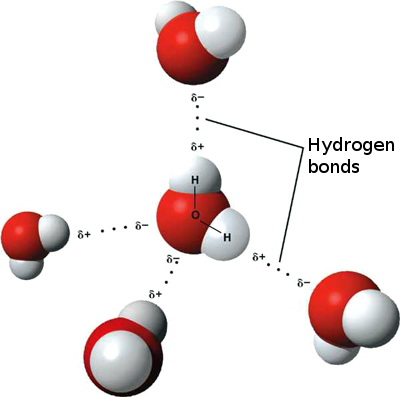
فرمول شیمیایی آب، H۲O است؛
مولکول آب از دو اتم هیدروژن و یک اتم اکسیژن تشکیل شدهاست
که باپیوندهای کوالانسی به هم متصل شدهاند.
اتمهای هیدروژن دارای مقداری بار مثبت هستند
و با زاویه نزدیک به ۱۰۵ درجه در اطراف اتم اکسیژن قرار گرفتهاند
که این موضوع باعث قطبی شدن پیوندهای مولکول آب شدهاست.
جرم مولی آب برابر ۱۸/۰۱۵ گرم بر مول میباشد
وزن مولکولی آب ۱۸/۰۱۵ است.
با این وزن مولکولی در
شرایط کره زمین (از نظر فشار و دما)
آب میبایستی بهحالت گاز باشد.
توجه کنیم که آب تقریباً سه چهارم مساحت زمین را پوشانیده
و تأثیر مهمی روی حرارت هوا و شرایط جوی دارد.
اگر آب این حالت استثنایی را نداشت تغییرات جوی،
شکل بلای آسمانی بهخود میگرفت؛
و حیات در آن پایدار نمیماند.
آب
بیبو، بیرنگ و بیطعم.
آب خواص ویژهای دارد که
آن را از دیگر مایعات متمایز کردهاست.
از این خواص ویژه میتوان به ظرفیت گرمایی بالا،
افزایش غیرعادی حجم به هنگام انجماد، کشش سطحی بالا،
گرانروی بسیار پایین و بالا بودن گرمای نهان تغییر فاز اشاره نمود.
دلیل بسیاری از این خاصیتها
وجود پیوند هیدروژنی در میان مولکولهای آب است.
چگالی آب در دمای ۲۵ درجه سانتیگراد و فشار ۱ اتمسفر
برابر ۰٫۹۹۸ گرم بر سانتیمتر مکعب است.
آب در فشار ۱ اتمسفر در دمای ۱۰۰ درجه سانتیگراد میجوشد
و در دمای صفر درجه سانتیگراد منجمد میشود.
همچنین آب در ۴ درجه سانتی گراد (دقیقاً ۳/۹۸ درجهٔ سانتیگراد)
بیشترین چگالی یعنی ۱ گرم بر سانتیمتر مکعب را دارد،
که این مسئله از لحاظ علمی بسیار جالب است و یک استثنا بهشمار میآید.
با آن که مولکول آب دارای بار الکتریکی نیست،
اما یک «دوقطبی الکتریکی» (Electric Dipole) بهشمار میآید.
همین قطبی بودن مولکولهای آب موجب شده
تا نیروی جاذبهٔ میان مولکولهای آن،
از نیروی جاذبهٔ میان مولکولهای دیگر حلالها بیشتر باشد.